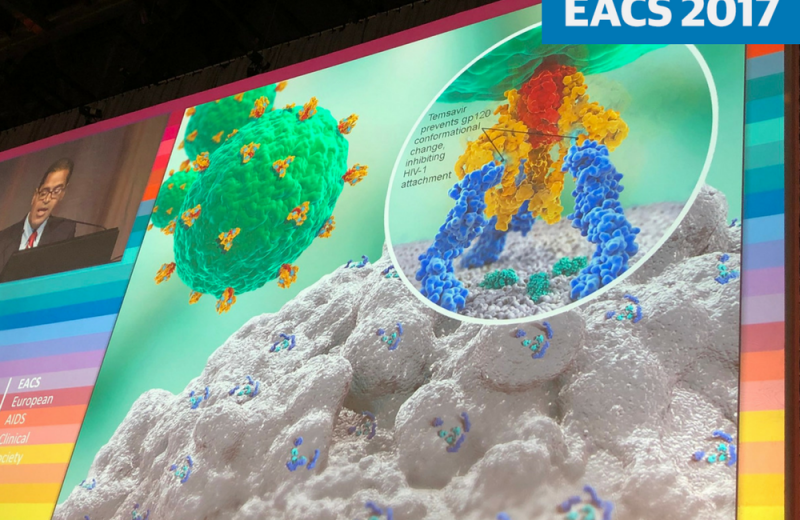
Презентация препарата Фостемсавир от Макса Латайада на выставке EACS 2017. Автор изображения: @chloe_orkin
Фостемсавир, новый экспериментальный ингибитор прикрепления, подавлял вирусную нагрузку более чем у половины участников с выраженной лекарственной устойчивостью при добавлении к фоновому режиму лечения, выбранному в результате тестирования на устойчивость, сообщил Макс Латайяд из ViiV Healthcare на 16-й Европейской конференции по СПИДу (EACS 2017) в Милане в пятницу.
Результаты были получены в ходе исследования BRIGHTE фазы 3, проведенного в Соединенных Штатах, Франции и Бразилии.
Фостемсавир (ранее BMS-663068) – это новый экспериментальный ингибитор прикрепления ВИЧ, который связывается с белком gp120 ВИЧ, предотвращая прикрепление ВИЧ к клеткам CD4. Другие ингибиторы проникновения ВИЧ-инфекции, энфувиртид и маравирок, играют ограниченную роль в лечении ВИЧ. Энфувиртид – это ингибитор синтеза ВИЧ, инъекционный препарат, который назначается только людям, у которых нет других вариантов лечения. Маравирок является антагонистом CCR5; он предотвращает использование ВИЧ рецептора CCR5 на поверхности CD4-клеток для проникновения в клетку. Его используют люди, имеющие опыт лечения.
Компания ViiV Healthcare разрабатывает Фостемсавир в качестве лекарственного средства для лечения людей, имеющих опыт лечения резистентностью к нескольким классам антиретровирусных препаратов. Препарат был приобретен у Bristol-Myers Squibb вместе с несколькими другими экспериментальными антиретровирусными препаратами в 2016 году.
В ходе клинических испытаний фостемсавира препарат был протестирован на людях с ВИЧ, которым доступны два или менее активных класса антиретровирусных препаратов.
Значительное меньшинство людей, живущих с ВИЧ, которые начали лечение в середине 1990-х годов, подверглись воздействию неоптимальных схем лечения и развили устойчивость к ненуклеозидным ингибиторам обратной транскриптазы, нуклеозидным ингибиторам обратной транскриптазы и большинству ингибиторов протеаз. Для таких пациентов может быть подобрана схема лечения, состоящая из ингибитора интегразы и других препаратов, обладающих частичной активностью в отношении вируса с лекарственной устойчивостью, но неясно, как долго можно ожидать, что такие схемы предотвратят повторное появление вируса.
В ходе 3-й фазы исследования фостемсавира, целью которого было лицензирование препарата для использования у людей, имеющих опыт лечения, участники были рандомизированы и получали фостемсавир в дозе 600 мг два раза в день или плацебо в течение 7 дней в дополнение к своему неэффективному режиму, после чего все участники получали фостемсавир в течение 24 недель вместе с базовым режимом, который не применялся ранее. был оптимизирован с помощью тестирования на устойчивость. Пациенты с опытом лечения имели право на участие в рандомизированном исследовании, если они не могли подобрать схему лечения, которая, вероятно, была бы полностью подавляющей из доступных в настоящее время препаратов, и имели чувствительность только к препаратам одного или двух классов антиретровирусных препаратов.
В исследование также была включена открытая группа участников, у которых не было полностью активных препаратов из существующих классов антиретровирусных препаратов, которые начали лечение фостемсавиром и режимом, оптимизированным с помощью тестирования на резистентность.
В общей сложности 272 человека были рандомизированы в соотношении 3:1 по сравнению с плацебо-контролируемой группой исследования; 99 человек были включены в открытую группу.
Участники исследования подвергались высокому риску дальнейшего прогрессирования ВИЧ-инфекции и нуждались в новых методах лечения. Среднее количество CD4-клеток в группе с плацебо-контролем составило 100 клеток/мм3, а в группе с открытой маркировкой – 41 клетка/мм3, у 72% всех участников исследования исходное количество CD4-клеток было ниже 200 клеток/мм3, а у 41% количество CD4-клеток было ниже 50 клеток/мм3, что указывает на очень высок риск заболевания, связанного со СПИДом.
Восемьдесят процентов участников исследования ранее применяли ингибиторы интегразы, а более 90% – ингибиторы протеазы. Менее половины участников рандомизированной группы принимали более одного полностью активного препарата в рамках оптимизированного фонового режима (42%). Из 272 участников, прошедших рандомизацию, 45 (17%) отказались от участия на 24-й неделе. В группе open label 26 из 99 участников (26%) отказались от участия на 24-й неделе.
Первичной конечной точкой исследования было среднее изменение вирусной нагрузки (РНК ВИЧ) с 1-го по 8-й день в рандомизированной когорте. Вирусная нагрузка снизилась в среднем на 0,79 log10 в группе фостемсавира и на 0,17 log10 в группе плацебо, разница составила 0,625 log10 (р < 0,001). Чуть менее чем у половины пациентов, принимавших фостемсавир, вирусная нагрузка снизилась на > 1 log10 (46%), а у 65% – на > 0,5 log10.
Среди пациентов с исходной вирусной нагрузкой > 1000 копий/мл (90% всех участников) среднее снижение вирусной нагрузки составило 1 логарифм10.
На 24-й неделе у 54% участников рандомизированной группы вирусная нагрузка была ниже 40 копий/мл, у 32% вирусная нагрузка превышала 40 копий/мл, и они продолжали принимать исследуемые препараты, 3% прекратили прием из-за недостаточной эффективности, побочных эффектов или смерти, а 6% изменили оптимизированный режим приема. фоновом режиме и были классифицированы как вирусологические неудачи. Остальные пациенты прекратили лечение из-за недостаточной эффективности, нежелательных явлений или смерти.
Серьезные нежелательные явления имели место у 30% участников (включая нерандомизированную группу) и привели к отмене исследуемого препарата у 6% всех участников. К ним относились инфекции, связанные со СПИДом, и другие явления, свидетельствующие о прогрессировании ВИЧ-инфекции у участников исследования. Наиболее распространенными побочными эффектами, связанными с приемом лекарств 2-4 степени тяжести, были тошнота, диарея, головная боль, рвота, повышенная утомляемость и слабость (астения).
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) признало фостемсавир прорывной терапией по результатам клинического анализа, и он будет быстро рассмотрен при подаче на лицензирование. Ожидается, что FDA рассмотрит заявку на получение лицензии в 2019 или 2020 году.
Рекомендации
Козал М. (представляет Латайяду). Исследование 3-й фазы применения фостемсавира у пациентов с ВИЧ-1, получавших интенсивное лечение: первичные результаты эффективности и безопасности на 8-й день и 24-ю неделю (исследование BRIGHTE, ранее 205888/AI438-047). 16-я Европейская конференция по СПИДу, 25-27 октября, Милан, тезисы докладов PS8/5, 2017.